Lorsqu'un ligand se fixe sur un récepteur, la réaction s'accompagne d'une libération ou d'une absorption de chaleur selon le signe de l'enthalpie standard, ![]() H0 , de la fixation. Les microcalorimètres modernes peuvent mesurer des très faibles variations de chaleur.
H0 , de la fixation. Les microcalorimètres modernes peuvent mesurer des très faibles variations de chaleur.
Titration calorimétrique isotherme (ITC)
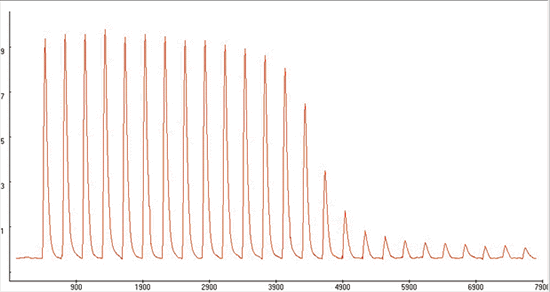
L'une des méthodes couramment utilisées pour étudier la fixation est la titration calorimétrique isotherme (ITC). Son principe est le suivant: des petites quantités de ligand sont ajoutées à une solution de protéines (environ 1 nmole dans un volume de 0,5 ml). Des constantes de fixation entre 102 et 108 M-1 sont accessibles. La chaleur dégagée ou absorbée est compensée pour maintenir la température constante. Les mesures ressemblent à ce qui est indiqué dans la figure ci-dessous, pour des quantités croissantes de ligand ajouté.
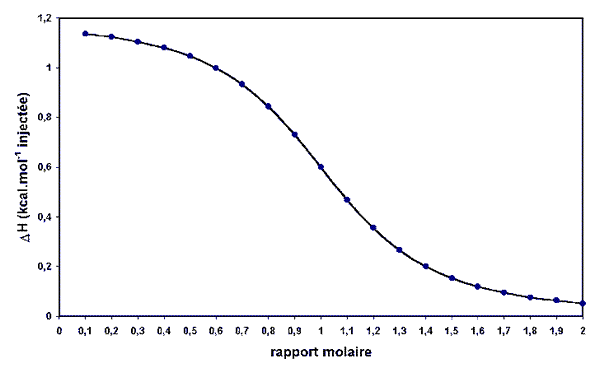
Le tracé de la chaleur mise en jeu en fonction de la proportion de ligand ajouté donne des courbes de titration du type ci-dessous, qui permettent de connaitre la constante de l'équilibre (quelquefois le nombre de sites), reliée à ![]() G0. Puisqu'on mesure aussi
G0. Puisqu'on mesure aussi ![]() H0, il est facile d'en déduire la dernière grandeur thermodynamique
H0, il est facile d'en déduire la dernière grandeur thermodynamique ![]() S0, permettant de tout connaitre de la liaison.
S0, permettant de tout connaitre de la liaison.
Calorimétrie différentielle à balayage
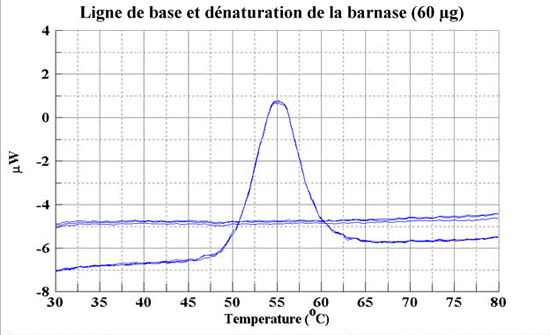
Ici, on balaye un échantillon (jusqu'à aussi peu que 50 µg) sur une gamme de températures donnée et on mesure les variation de chaleur absorbée. On détermine ainsi Tm, ![]() H (enthalpie), et
H (enthalpie), et ![]() Cp (capacité calorifique). Ceci permet surtout de mettre en évidence des transitions de phase dans des molécules biologiques ("fusion" de lipides, dénaturation de protéines (de domaines), "fusion" d'ADN; effets de ligands sur la stabilité thermique des protéines et acides nucléiques etc).
Cp (capacité calorifique). Ceci permet surtout de mettre en évidence des transitions de phase dans des molécules biologiques ("fusion" de lipides, dénaturation de protéines (de domaines), "fusion" d'ADN; effets de ligands sur la stabilité thermique des protéines et acides nucléiques etc).
Exemple de la dénaturation de la barnase
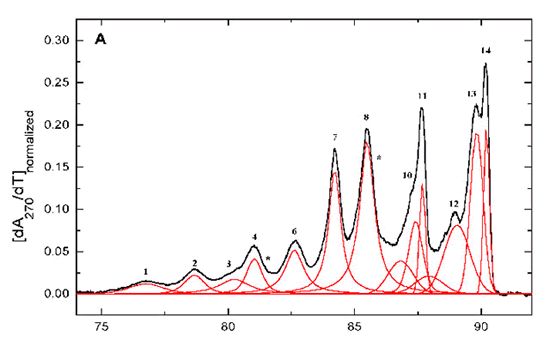
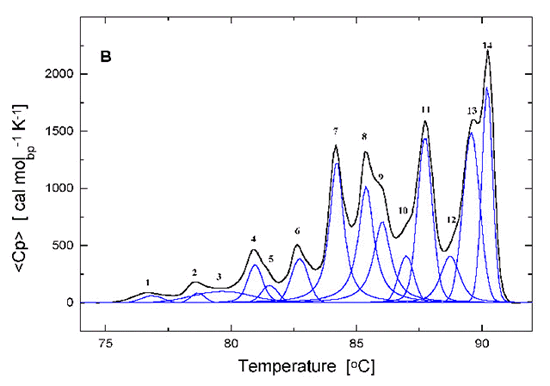
Exemple de fusion d'un palsmide (pBR322) montrant la fusion de différentes régions (selon J. Völker, R.D. Blake, S.G. Delcourt, and K. J. Breslauer, "High Resolution Calorimetric and Optical Melting Profiles of DNA Plasmids: Resolving Contributions from Intrinsic Melting Domains and Specifically Designed Inserts," Biopolymers, (1999)) mesurée par variation d'absorbance à 270 nm ou par DSC