Les propriétés optiques d'une protéine changent très souvent en fonction de la fixation d'un ligand. En effet, la structure tridemsionnelle est modifiée par cette liaison ce qui entraîne des changements des spectres d'absorption ou d'émission des résidus aromatiques (Tyr, Trp essentiellement). On utilise ce changement pour suivre la saturation des sites de liaison.
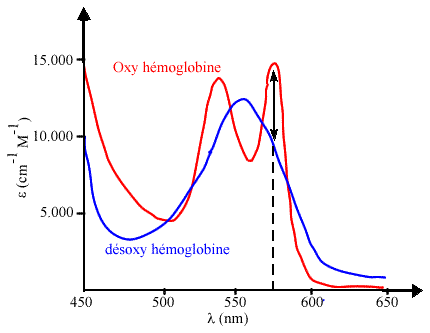
Sur l'exemple de la myoglobine (ou de l'hémoglobine, dont les spectres sont presque identiques), on opère de la façon suivante. On choisit une longueur d'onde où la différence est la plus grande en passant de la forme libre (désoxy) à la forme saturée (oxy). Sur la figure ici, il s'agit de 570 nm. La courbe de saturation ressemble à celle indiquée ci-dessous:
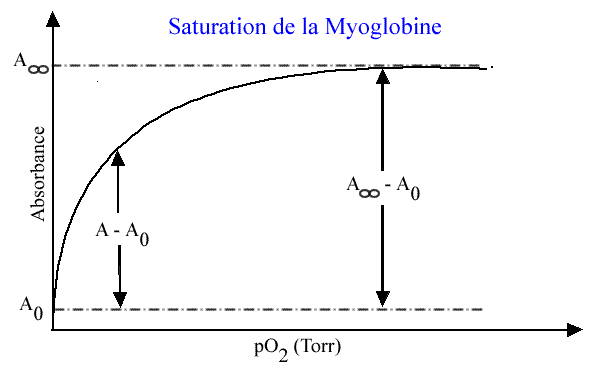
En absence d'oxygène: A0 = ε désoxy . l . ctotal
En présence d'une concentration saturante d'oxygène: A00 = εoxy . l . ctotal
et donc: A00 - A0 = (εoxy - εdésoxy ) l . ctotal A0
avec: θ = (oxy) / ctotal et (désoxy) = (1 - θ) / ctotal
Pour une concentration intermédiaire: A = Aoxy + Adésoxy = θ. ctotal l εoxy. + (1 - θ ) . ctotal l εdésoxy.
Et donc : A - A0 = (εoxy- εdésoxy) l θ.ctotal.
Enfin:
( A - A0 ) / ( A00 - A0 ) = θ
Ce qui signifie que l'on détermine ainsi directement θ.





