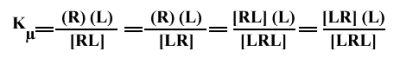Prenons le cas d'un récepteur constitué de n sous-unités identiques. Chacune d'elles possède un site de liaisons. La protéine réceptrice possède dons n sites de liaison, et tous les sites ont la même affinité vis-à-vis du ligand puisqu'ils sont identiques. Rajoutons qu'il n'y a pas d'interaction entre les sites, c'est-à-dire que la liaison d'un ligand sur une sous-unité ne modifie pas l'affinité des autres sites. On parle alors de sites indépendants et équivalents. Lorsqu'on réalise une expérience de liaison avec un tel système purifié, et si on connait (R)T, on obtiendra un graphe de Scatchard identique au graphe 5, c'est-à-dire une seule droite. La différence est, que dans ce cas, l'abscisse à l'origine ne sera plus égale à 1.
Constantes macroscopiques et microscopiques : Facteurs statistiques
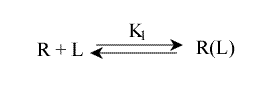
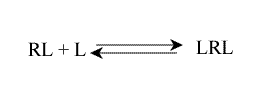
Considérons, à titre d'exemple, un récepteur, R, constitué de deux sous unités identiques, chacune capable de fixer un ligand L, un à droite l'autre à gauche. L'affinité de chaque sous unité est évidemment la même (puisqu'elles sont identiques) et les deux sites sont suffisamment éloignés pour être indépendants.
On peut écrire l'équilibre macroscopique, seul mesurable, sous la forme :
Avec R(L) : le récepteur ayant fixé un ligand, sans préjuger de son site de fixation, contrairement à LR et RL. La concentration (R(L)) est mesurable: c'est la concentration de toutes les formes de complexe ayant fixé un seul ligand. Par contre, celle de [LR] ou de [RL] ne peut être déterminée expérimentalement.
Les constantes de dissociation macroscopique s'écrivent :
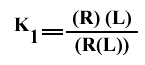 et
et
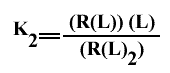
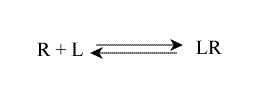
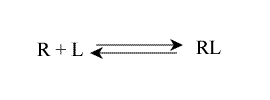
L'équilibre microscopique, relatif aux sites individuels, peut s'écrire :
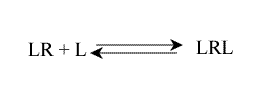
En considérant des sites équivalents et indépendants, tous ces équilibres ont la même constante d'équilibre microscopique, Kµ :
On aura donc, pour les concentrations mesurables (en utilisant 0 pour indiquer que le site est libre dans les concentrations non mesurables) :
(R) = [0R0]
(R(L)) = [LR0] + [0RL]
(R(L)2) = [LRL]
Donc, bien que les Kµ soient les mêmes, on a :
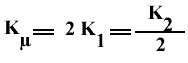 D'où :
D'où : ![]()
On peut généraliser le système : soit un récepteur, R, qui possède n sites de fixation. L'équilibre de liaison pour le ième site, 1 < i < n, est :
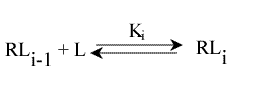
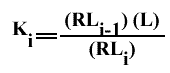
Avec Ki : constante macroscopique de dissociation.
La constante de dissociation microscopique, Kµ, est identique pour tous les sites puisqu'ils sont équivalents et indépendants :
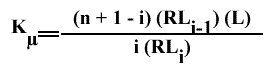
Avec :
n : nombre total de sites
i : nombre de sites de liaison occupés
n + 1 - i : nombre de sites restant disponibles
toutes les concentrations sont mesurables
D'où :
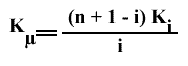
On verra plus loin une application de ce résultat pour des équilibres de fixation multiple.
Fixation sur un récepteur formé de n sous-unités équivalentes et indépendantes
Reprenons le cas d'un récepteur constitué de n sous-unités identiques. Chacune d'elles possède un site de liaisons et tous les sites ont la même affinité vis-à-vis du ligand puisqu'ils sont identiques. Il n'y a pas d'interaction entre les sites. De plus, supposons que dans le milieu étudié, seul ce récepteur est capable de lier le ligand L.
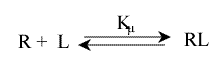
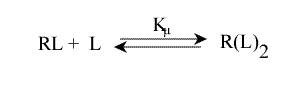
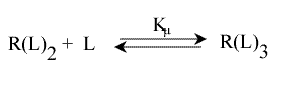
Une erreur à ne pas commettre est d'écrire l'équilibre sous cette forme :
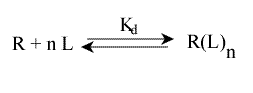
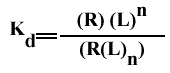
Cela ne représente pas la décomposition en n sites équivalents, qu'il faut écrire :
.............
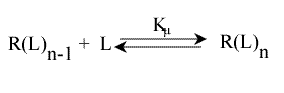
Et tous ces sites ont la même constante de dissociation microscopique puisqu'ils sont équivalents. En exprimant Kµen fonction des concentrations mesurables et des facteurs statistiques, avec n = 2, par exemple :
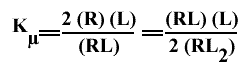
et
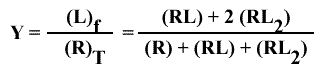
(RL) / (RL2) = 2 Kµ / (L)
(R) / (RL) = Kµ / [ 2 (L) ]
(R) / (RL2) = [ (R) / (RL) ] [ (RL) / (RL2) ] = [ Kµ / [ 2 (L) ]] [ 2 Kµ / (L) ] = [ Kµ / (L) ]2
Y = { [ (RL) / (RL2) ] + 2 } / { [ (R) / (RL2) ] + [ (RL) / (RL2) ] + 1
= { 2 [ [ Kµ / (L) ] + 1 ] } / { [ Kµ / (L) ]2 + [ 2 Kµ / (L) ] + 1 }
= { 2 [ [ Kµ / (L) ] + 1 ] } / { [ Kµ / (L)] + 1 ]2 }
= 2 / { [ Kµ / (L) ] + 1 } = { 2 (L) } / { Kµ + (L) }
2 - Y = 2 Kµ / { [ Kµ / (L) ] + 1 }
D'où :
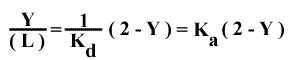
Et, en généralisant le système pour un récepteur ayant n sites de fixation :
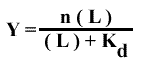 et
et 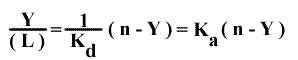
Le graphe de Scatchard obtenu sera identique au graphe 5, c'est-à-dire une seule droite mais ici l'abscisse à l'origine sera égale à n, nombre total de sites de liaison.
Si maintenant on ne connaît pas ( R )T, on ne peut tracer le graphe de Scatchard mais on pourra toujours tracer le graphe 6 (l'allure sera exactement la même).
L'interprétation de ce graphe 6, notamment au niveau de l'abscisse à l'origine, va dépendre de ce que l'on connaît du système étudié.
Si l'on connaît la structure du récepteur, c'est-à-dire le nombre de sites de liaison par protéine réceptrice, alors ce graphe permettra d'atteindre la concentration en récepteur dans l'échantillon. Dans ce cas, l'abscisse à l'origine donnera la concentration des sites de liaison présents dans la préparation. Pour atteindre la concentration en protéine réceptrice, il suffira de la diviser par le nombre de sites présents sur une protéine réceptrice ( par n).
Par contre si l'on ne connaît pas la structure de la protéine en termes de nombre de sites par protéine réceptrice, le graphe 6 s'interprètera simplement en notant qu'il n'y a qu'une seule classe de sites équivalents et indépendants. L'abscisse à l'origine sera elle, par abus de langage, exploitée en termes de concentration en récepteur, alors qu'en toute rigueur il s'agit là de site de liaison. Ici, en fait, l'expérimentateur utilise le modèle d'un seul site de fixation par protéine réceptrice.
Fixation sur plusieurs classes de sites
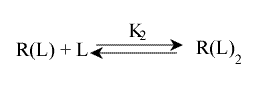
Dans un milieu biologique complexe, il peut arriver qu'il y ait plusieurs types de récepteurs capables de fixer un même ligand. Le ligand a une affinité différente, mais élevée (contrairement à celle d'une liaison non spécifique) pour chaque classe de récepteurs. Considérons, par exemple, l'existence de deux classes de sites équivalents et indépendants. Dans le milieu, il y a n1 sites de type 1 ayant une affinité K1 pour le ligand, et n2 sites de type 2 avec une constante d'affinité K2. Dans ce cas :
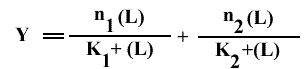
Donc
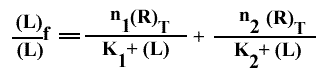
Et le graphe :
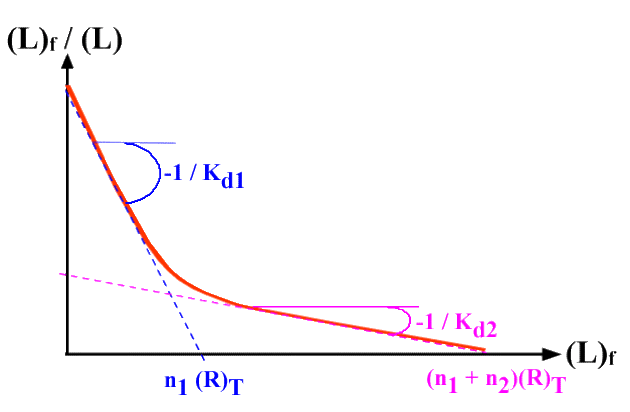
Relation entre la liaison du ligand sur son récepteur et les effets physiologiques
La description des effets physiologiques de la fixation des agonistes ou des antagonistes est en dehors des objectifs de ce cours (voir les documents et les cours de physiologie et de pharmacologie). Le seul point qui nous intéresse ici est de savoir quels changements de conformation du récepteur découlent de la liaison du ligand et comment ces changements de conformation entraînent les événements suivants: la fixation d'un récepteur nucléaire à un des éléments de réponse génomiques, l'ouverture d'un canal ionique, la dissociation d'une protéine G trimérique ou l'activation d'une kinase.
Les seuls exemples traités ici sont :
les récepteurs intracellulaires aux stéroïdes
les récepteurs canaux (sur l'exemple du récepteur au glutamate appelé GluR2)