Il arrive que l'on observe un comportement anormal de l'enzyme lorsque la cinétique est mesurée en présence d'une trop forte concentration en substrat. Voilà ce que l'on peut observer : dans une représentation de Michaëlis, on observe que la vitesse passe par un maximum quand la concentration en substrat augmente au lieu de tendre vers VM.
Ce qui se traduit ainsi sur une représentation de Lineweaver - Burk.
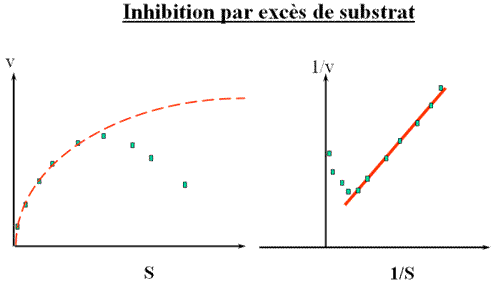
Le substrat peut se loger dans le site actif avec une orientation anormale, interdisant à la réaction de se faire.
Cette anomalie peut s'expliquer structuralement par la formation d'un complexe ES2., schématisée dans ce dessin : 2 substrats se trouvent simultanément dans le site actif.

Ce cas est analogue à celui de l'inhibition conditionnelle, en remplaçant le symbole I par le symbole S. Le résultat :
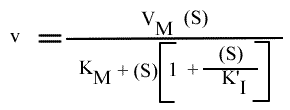
s'obtient de la même façon.
Ceci conduit à une vitesse qui passe par un maximum quand la concentration de S augmente, au lieu de tendre vers VM.





