Document de cours
Fondamental :
Comprendre l'état quasi stationnaire
Résoudre les équations selon le modèle de Michaëlis
Déterminer les paramètres de la cinétique mono substrat
Equations différentielles et résolutions.
Equations utilisées :
(E)T = (E) + (ES)
d(ES)/dt = k1(E) (S) - ( k-1 + k2 ) (ES)
v = d(P) / dt = k2 (ES)
VM = k2 (E)T
Les trois possibilités :
Résolution du système
1°) Simulation numérique de l'intégration des équations différentielles 2 et 3.

2°) Résolution dans l'hypothèse de l'Etat Quasi Stationnaire( EQS ):
les simulations ci-dessus montrent que, sauf au tout début et à la fin de la réaction (cette phase initiale est appelée phase préstationnaire), la concentration en complexe ES est presque constante à condition que la concentration initiale du substrat soit bien supérieure à celle de l'enzyme (ce qui ne signifie pas qu'elle soit saturante). Par conséquent, la vitesse de synthèse de ES doit être égale à la vitesse de déroulement de la réaction
En EQS, il faut que le substrat soit en excès c'est-à-dire que: (S) >> (E)T.
Dans ce cas on pose:
d(ES) / dt = 0 avec KM = (E) (S) / (ES) = ( k-1 + k2) / k1 .
KM est une pseudo constante de dissociation.
Et il en découle:
(E) = (ES) KM / (S) (E)T = ( 1 + [KM / (S) ] (ES)
v = [ k 2 (E)T (S) ] / [ KM + (S) ]
v = VM (S) / [ KM + (S) ]
La concentration en substrat dans cette expression est, bien évidemment la concentration initiale en substrat. On en déduit que la proportion de produit P fabriquée pendant la cinétique doit être faible pour que la concentration en S soit constante. En d'autres termes, (P) < 10 % (S)0. Il est donc préférable d'utiliser dans ces équations, la vitesse initiale (vitesse mesurée avant que plus de 10% de substrat n'ait été transformé en produit) plutôt que la vitesse moyenne afin de minimiser l'influence de facteurs parasites tels que les effets de la réaction inverse, l'inhibition de la réaction par les produits et l'inactivation progressive de l'enzyme.
L'EQS est une notion fondamentale avec laquelle il faut se familiariser. Considérons une rivière au débit régulier. Elle garde en tout point de son cours un niveau constant bien que l'eau s'y renouvelle en permanence. Cette image symbolise assez bien un état quasi stationnaire. Il est surtout nécessaire de ne pas confondre un EQS, une sorte d'équilibre dynamique d'aspect figé, avec les équilibres vrais étudiés en thermodynamique : ces derniers concernent des systèmes clos, n'échangeant aucune matière vers l'extérieur et le facteur temps n'intervient pas.
3°) Résolution dans l'hypothèse du Pré-Equilibre Rapide ( PER ):
Le PER est un cas particulier de l'EQS donc le substrat est toujours un excés ( (S)>>(E)T ) mais en plus, ici, la constante cinétique k2 est négligeable devant k-1 .
Lenor Michaelis et Maude Menten furent les premiers à poser cette hypothèse (1913)
KM= k-1/ k1.
KM est une vraie constante de dissociation
L'expression de la vitesse de réaction est inchangée.
v = VM (S) / [ KM + (S) ]
Attention :
La condition de PER ou d'EQS ne dépend pas de l'expérimentateur, mais seulement des valeurs des constantes de vitesse.
Remarque :
Bien que cette hypothèse du PER ne se vérifie pas souvent, par reconnaissance pour ce travail de pionnier, le complexe Enzyme-Substrat non covalent, ES, est appelé complexe de Michaelis et KM est la constante de Michaëlis
Les grandeurs de la cinétique
VM
En général, une u.e. (unité enzymatique) est la quantité d'enzyme qui permet la formation de une micromole de produit en une minute, dans les conditions saturantes en substrat.
k2
Lorsque l'on connaît (E)T, on détermine k2 ,souvent appelé k catalytique ou k cat :
k2 = VM / (E)T
k2 a la dimension inverse à celle d'un temps: T-1.
La valeur de k2 est caractéristique de la rapidité de l'enzyme.
On l'appelle fréquence de rotation (ou "turn over").
k2 / KM
Critère de l'efficacité globale d'une enzyme: plus k2 est grand et plus KM est petit et plus l'enzyme est à la fois efficace et rapide.
Le rapport k2 / KM dépend de k1, k-1 et k2 :
k2 / KM = k2 k1 / (k-1 + k2 ) = k1 / ( 1 + ( k-1 / k2 ) ) < k1
La limite de ce rapport k2/KM est donc k1, c'est à dire le taux de formation du complexe ES. Ce taux est lui-même limité à 108-109 M-1 s-1 par la diffusion qui permet la rencontre de l'enzyme avec le substrat.
Les graphes de la cinétique enzymatique
Représentation de Michaëlis : v = f ( (S))
Attention :
Si l'on souhaite quantifier les paramètres de la cinétique, KM et VM, il vaut toujours mieux linéariser.
Représentation de Lineweaver-Burk : 1 / v = f ( 1 / (S) )
1 / v = ( KM / VM ). ( 1 / (S) ) + 1 / VM
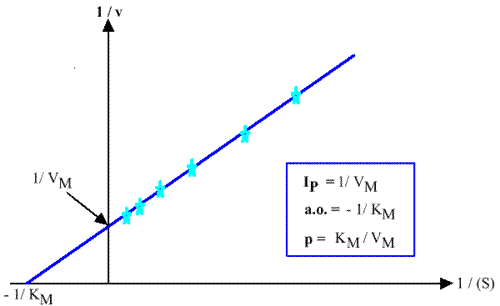
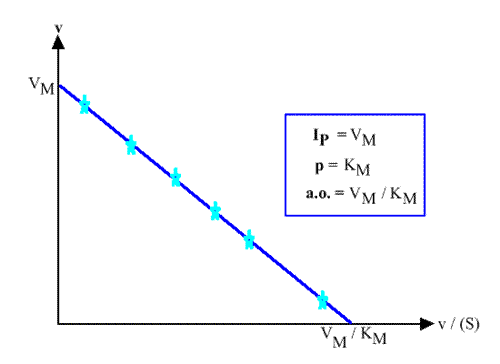
Représentation de Eadie-Hofstee : v = f ( v / (S) )
v = VM - ( Km v / (S) )
Complément :
Enfin, les réactions (catalysées ou non) sont souvent réversibles ce qui introduit une expression différente de la vitesse.





